Número cuántico
Los números cuánticos describen los valores de las variables dinámicas que se conservan en los sistemas cuánticos. Corresponden por tanto con aquellos observables que conmutan con el Hamiltoniano del sistema. Así, los números cuánticos permiten caracterizar los estados estacionarios, es decir los estados propios del Hamiltoniano.En física atómica, los números cuánticos son valores numéricos discretos que nos indican las características de los electrones de los átomos, esto está basado en la teoría atómica de Niels Bohr que es el modelo atómico más aceptado y utilizado en los últimos tiempos por su simplicidad.
En física de partículas también se emplea el término números cuánticos para designar a los posibles valores de ciertos observables o magnitud física que poseen un espectro o rango posible de valores discreto.
Ejemplo: Átomos hidrogenoidesEl conjunto de números cuánticos más ampliamente estudiado es el de un electrón simple en un átomo: a causa de que no es útil solamente en química, siendo la noción básica detrás de la tabla periódica, valencia y otras propiedades, sino también porque es un problema resoluble y realista, y como tal, encuentra amplio uso en libros de texto.
En mecánica cuántica no-relativista el Hamiltoniano de este sistema consiste de la energía cinética del electrón y la energía potencial debida a la fuerza de Coulomb entre el núcleo y el electrón. La energía cinética puede ser separada en una parte debida al momento angular, J, del electrón alrededor del núcleo, y el resto. Puesto que el potencial es esféricamente simétrico, el Hamiltoniano completo conmuta con J2. A su vez J2 conmuta con cualquiera de los componentes del vector momento angular, convencionalmente tomado como Jz. Estos son los únicos operadores que conmutan mutuamente en este problema; por lo tanto, hay tres números cuánticos. Adicionalmente hay que considerar otra propiedad de las partículas denominada espín que viene descrita por otros dos números cuánticos.
En particular, se refiere a los números que caracterizan los estados propios estacionarios de un electrón de un átomo hidrogenoide y que, por tanto, describen los orbitales atómicos. Estos números cuánticos son:
I) El número cuántico principal (n = 1, 2, 3, 4 ...), indica el nivel de energía en el que se halla el electrón. Esto determina el tamaño del orbital. Toma valores enteros. Se relaciona con la distancia promedio del electrón al núcleo del orbital.
II) El número cuántico del momento angular o azimutal (l = 0,1,2,3,4,5,...,n-1), indica la forma de los orbitales y el subnivel de energía en el que se encuentra el electrón.
Si:
l = 0: Subórbita "s" ("forma circular") →s proviene de sharp (nitido) (*)
l = 1: Subórbita "p" ("forma semicircular achatada") →p proviene de principal (*)
l = 2: Subórbita "d" ("forma lobular, con anillo nodal") →d proviene de difuse (difuso) (*)
l = 3: Subórbita "f" ("lobulares con nodos radiales") →f proviene de fundamental (*)
l = 4: Subórbita "g" (*)
l = 5: Subórbita "h" (*)
(*)Para obtener mayor información sobre los orbitales vea el artículo Orbital
III) El número cuántico magnético (m), Indica la orientación espacial del subnivel de energía, "(m = -l,...,0,...,l)". Para cada valor de l hay 2l+1 valores de m.
IV) El número cuántico de spin (s), indica el sentido de giro del campo magnético que produce el electrón al girar sobre su eje. Toma valores 1/2 y -1/2.
En resumen, el estado cuántico de un electrón está determinado por sus números cuánticos:
| nombre | símbolo | significado orbital | rango de valores | valor ejemplo |
|---|---|---|---|---|
| número cuántico principal |  |
shell o capa |  |
 |
| número cuántico secundario o azimutal (momento angular) |  |
subshell o subcapa |  |
para
 : :
|
| número cuántico magnético, (proyección del momento angular) | 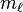 |
energía shift |  |
para
|
| número cuántico proyección de espín |  |
espín | 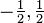 |
para un electrón, sea: 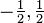 |
Con cada una de las capas del modelo atómico de Bohr correspondía a un valor diferente del número cuántico principal. Más tarde se introdujeron los otros números cuánticos y Wolfgang Pauli, otro de los principales contribuidores de la teoría cuántica, formuló el celebrado principio de exclusión basado en los números cuánticos, según el cual en un átomo no puede haber dos electrones cuyos números cuánticos sean todos iguales. Este principio justificaba la forma de llenarse las capas de átomos cada vez más pesados, y daba cuenta de por qué la materia ocupa lugar en el espacio.
Desde un punto de vista mecano-cuántico, los números cuánticos caracterizan las soluciones estacionarias de la Ecuación de Schrödinger.
No es posible saber la posición y la velocidad exactas de un electrón en un momento determinado, sin embargo, es posible describir dónde se encuentra. Esto se denomina principio de incertidumbre o de Heisenberg. La zona que puede ocupar un electrón dentro de un átomo se llama orbital atómico. Existen varios orbitales distintos en cada átomo, cada uno de los cuales tiene un tamaño, forma y nivel de energía específico. Puede contener hasta dos electrones que, a su vez, tienen números cuánticos de espín opuestos.


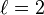 :
: